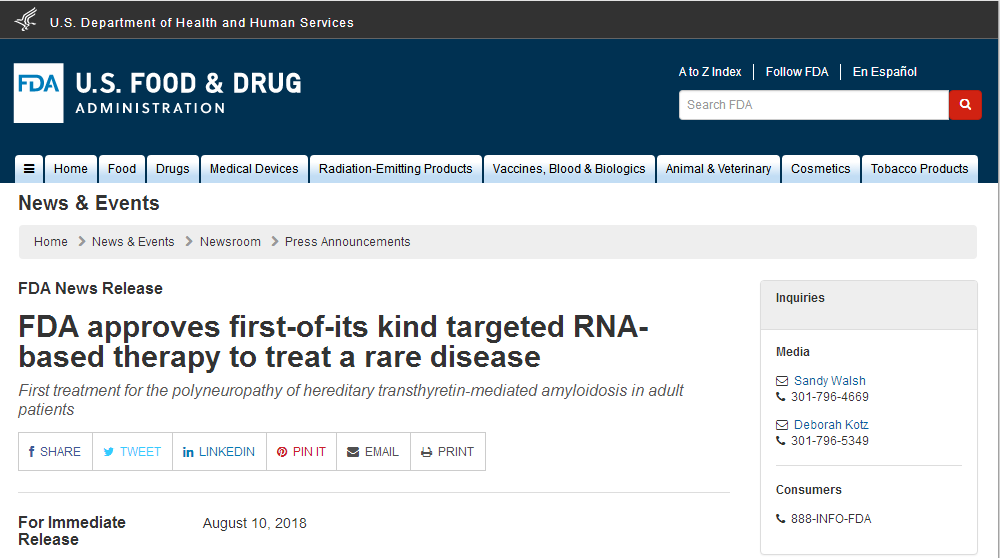
2018年8月10日具有特别的意义!
因为,这一天等待了12年的RNAi疗法在美国上市了!
美国Alnylam Pharmaceuticals和赛诺菲旗下的Genzyme的一款用于治疗hATTR淀粉样变性的疾病的RNAi新药(Onpattro)patisiran获得美国FDA批准上市,距离2017年9月完成临床III期试验终点仅仅过去不到一年时间。此前,美国FDA授予patisiran突破性疗法认定和孤儿药资格,英国授予patisiran“早期获取”(Early Access)资格,允许患者在这款疗法正式问世前就能得到治疗。RNAi疗法今日的上市,必将掀起一场制药行业的革命,也是RNAi这一诺贝尔奖成果从概念走向实际治疗用途的一个光辉里程碑。
RNAi机制发现:2006年诺贝尔生理学或医学奖
RNAi是一种通过双链RNA对基因进行沉默的方法,在植物、动物、人类中均存在。虽然RNAi现象的发现早在1990年左右,当时却没有转化为实际应用,直到1998年斯坦福大学Andrew Fire教授和马萨诸塞大学Craig Mello教授在研究秀丽新小杆线虫(C. elegans)反义RNA过程中,发现由dsRNA介导的同源RNA降解过程,并阐明从特定基因降解mRNA的方式并正式命名为RNAi,之后RNAi技术很快被用于后基因组时代确定各种基因功能及其同疾病的关系,也被认为是一种具有巨大商业价值的潜在靶向疗法。2006年47岁的Andrew Fire和45岁的Craig Mello由于在RNAi机制研究中的贡献获得诺贝尔生理学或医学奖。

什么是核酸药?
核酸药物一般指寡核酸药物,包括 siRNA、miRNA、Antisense、CpG、Aptamer、CRISPR gRNA等,被认为是继抗体药物及细胞免疫疗法的下一代药物。核酸药理论上可以达到传统药物无法替代的效果,例如抗体只能作用于细胞表面,而核酸药物向小分子药物一样在细胞内发挥作用,甚至可以作用到细胞核并具有精确的靶向性。现今人类面临的 8000 多种疾病,其中7000 多种是遗传性罕见病,其发病率低、在临床治疗上几乎无药可治,核酸药物对这种单基因疾病非常有优势,例如遗传疾病、眼科疾病、艾滋病、肿瘤等罕见病和重大疾病。精准医疗概念普及大时代下,不同基因差异或表达异常引起的疾病,理论上核酸药都可对其进行个性化开发。
RNAi疗法的探索
在2000年人类基因组草图绘制工作基本完成之后,许多制药公司和研究人员开始在哺乳动物细胞中尝试运用RNAi技术研发创新核酸药,通过RNAi机制抑制基因的表达,阻断从跟疾病相关的从mRNA到蛋白质的翻译过程,从而预防或治疗与此相关的疾病,尤其是几千种尚未找到适合疗法的遗传性疾病、肿瘤、神经疾病、眼科疾病等,还可以规避致病蛋白成药性难的问题。同时,RNA可以大规模人工合成并在碱基分子水平进行修饰和药物设计。然而RNAi疗法的难点在于如何将核酸药无递送至人体内的正确细胞。2005年至2009年,RNAi领域吸引了数十亿美元的资金投入,但之后各大制药巨头,罗氏、辉瑞、默沙东、诺华开始分分割肉离场,主要原因在于RNAi疗法却一直未找到适合的靶向递送方法,即仅在需要的病灶位置或细胞中启动RNAi治疗,否则就会没有效果或者导致危险的副作用。
2010年Alnylam发表了基于配体技术的RNAi靶向递送的重要成果,GalNac 共轭连接的 siRNA 核酸药物可以有效靶向肝细胞,这在核酸药物靶向递送上迈出关键一步,公司目前有多达7个新药研发管线,除今日获批的Patisiran,还有3个处于临床II期和III期,另有3个处于早期开发。
RNAi疗法治疗遗传性TTR介导(hATTR)淀粉样变
遗传性运甲状腺素蛋白(TTR)介导(hATTR)淀粉样变是一种遗传的、使人逐渐衰弱的、由TTR基因突变引起的致命疾病。TTR蛋白主要在肝脏中产生,通常是维生素A的载体,TTR突变导致异常的淀粉样蛋白积累,并损伤身体器官和组织,如外围神经和心脏,导致难以治疗的外周感官神经病变、自主神经病变和心肌病。hATTR淀粉样病是一个重大未满足的医疗需求,发病率和死亡率很高,全世界影响着约5万人,平均寿命为2.5 – 15年。
RNAi疗法可以利用身体天然机制,降低引起TTR淀粉样变的TTR蛋白的水平。具体方法是将siRNA包裹在脂质纳米颗粒中,在输注治疗中将药物直接递送至肝脏,干扰异常形式TTR的RNA产生,通过靶向和沉默特定mRNA,阻碍TTR蛋白生成,帮助减少周围神经中淀粉样沉积物的积累并恢复这些组织的功能。
核酸药未来展望
2018年是RNAi核酸药上市元年,加之全球范围内目前进入早期研发或进入临床I期、II期和III期试验的上百个核酸药品种,RNAi疗法获批上市这一标志性事件,将是一个巨大的鼓舞和带动。
美国FDA局长Scott Gottlieb博士说:“像RNA抑制剂这样能改变疾病基因驱动的新技术,有可能为医学界带来转变,使我们能更好地面对、甚至治愈衰弱疾病。我们致力于推进科学原则,以便有效地开发和审查突破性疗法的安全性和疗效,来改变患者的生命。” 我们相信核酸药及其RNAi疗法的未来将具有光明的前景,期待更多创新核酸药走向临床、走向市场并惠及全球。

美国FDA局长Scott Gottlieb博士(图片来源: The New York Times)
补充信息:全球部分核酸药获批情况
Cortellis 数据(2017年12月)全球至今共记录有1590 个寡核苷酸类药物,目前处于有效研发阶段药物共计731 个,临床前发现574(78.5%),上市和预注册11个(1.5%),III期,临床16个(2.1%)。上述核苷酸类药物适应症分布情况为恶性肿瘤(25%)、中枢神经系统疾病(14%),传染病(9%),罕见病(9%),眼部疾病(8%),心血管(6%),疼痛和炎症(5%)等。
● 1998年,FDA批准Ioins公司的Vitravene反义核酸药批准上市
● 2013年,FDA批准赛诺菲旗下Genzyme的寡核苷酸药物Mipomersen上市,治疗纯合子型家族性高胆固醇血症(HoFH),作为降脂药物和饮食的辅助药物。
● 2016年9月,FDA批准Sarepta Therapeutics公司的Exondys 51 (eteplirsen),用于治疗外显子51跳跃型杜氏肌营养不良(DMA), 成为首个FDA批准的DMA药物
● 2016年12月,FDA批准Biogen/Ionis公司Spinraza(nusinersen),用于治疗成人及儿童脊髓型肌萎缩(SAM)成为FDA首个批准的SAM药物,2017年6月EMA批准其上市。
● 2018年8月,FDA宣布批准基于RNAi疗法的Onpattro(patisiran)输注治疗,用于由遗传性转甲状腺素蛋白淀粉样变性(hATTR)引起的周围神经疾病。
关于锐博生物
锐博生物在核酸药靶向系统开发上获得进展并能为其合作伙伴提供关键技术支持,此外2017年锐博生物与GE医疗宣布共建大规模的寡核酸原料药生产基地,此次战略合作让国内的核酸药研发水平与欧美的差距缩小到五年以内,也是中国大陆首次引进OligoProcess核酸工业合成系统(1800nmol)和IN Cell Analyzer 6500HS激光共聚焦高通量高内涵细胞平台,加之锐博生物十多年来专注于核酸技术与经验积累,为核酸药从早期筛选到临床转化提供重要合作平台,覆盖核酸新药发现、制造工艺、分析方法及药化研究、临床研究用寡核酸生产、商业化API生产、制剂与灌装、药品注册事务等CRO和CDMO全周期环节。2016年,锐博生物获得CFDA颁发的寡核酸原料药生产许可证。
锐博生物还同韩国Olix公司、上海泽润生物科技有限公司等达成寡核酸生产战略合作,截止目前已为来自全球范围的合作客户完成近100项合同开发及生产服务。
